28. Kalenderwoche
Die innere Logik der Glykolyse
Stoffwechselwege folgen einer inneren Logik, die ihrem Ablauf eine klare, leicht nachvollziehbare Richtung geben. So löst der Pentosephosphatweg (nicht-oxidativ) das Problem der Regeneration von Glc (C6) aus Ribose (C5) auf algebraisch einfachstem Weg:
2 Ribosemoleküle (mit insgesamt 10 C-Atomen) würden theoretisch durch C1-Transfer zu C6 + C4 führen (nicht bekannt)
3 Ribosemoleküle ergeben rechnerisch 2 x C6 + 1 x C3, und dies in drei Schritten wie folgt:
C5 + C5 zu C7 + C3 (Transketolase)
C7 + C3 zu C6 + C4 (Transaldolase)
C4 + C5 zu C6 + C3 (Transketolase)
Somit ist der Ablauf algebraisch vorgegeben. Und nun zur Glykolyse.
Die Energiegewinnung erfolgt zwangsläufig durch Abbau. Wenn die Spaltung von Glc zu 2 gleichen C3-Einheiten führt, dann können in Phase 2 beide im selben Weg verwertet werden, es müssen dann aber eine Spaltung und danach ggf. eine Isomerisierung erfolgen können. Vorteil: der Gewinn pro Glc multipliziert sich mit dem Faktor 2.
Die Glykolyse beginnt mit Glc-6-Phosphat (nach Mutasereaktion von Glc-1-phosphat aus Glykogenabbau). Bildung von Fruktose-6-phosphat stellt die Ketofunktion für die Bindung an Aldolase (zur Spaltung) bereit, Phosphorylierung zum 1,6-Bisphosphat schafft Symmetrie der später entstehenden Spaltprodukte (s. Fruktoseabbau unten).
Nun, bisher haben wir nur Energie investiert: also ist dieses Enzym ein wesentlicher Regulationspunkt (z.B. durch das 2,6-Bisphosphat)! Aldolase spaltet nun diese Substrat zu den Glyceral- und Glyceronphosphaten, die durch die Triosephosphatisomerase ins Gleichgewicht gebracht werden. Nur die Aldose kann oxidiert werden (Ketone sind nicht reaktiv).
Oxidation führt zu einem Säureanhydrid in Position 1, das ATP Bildung ermöglicht. Wie entsteht nun ATP mit dem Phosphoester?
Die Enolform von Pyruvat ist thermodynamisch ungünstig, die Ketoform begünstigt. Die Bildung von Phosphoenolpyruvat ist möglich, weil die Phosphatgruppe die energetisch favorisierte Umwandlung verhindert. Ein Energiegewinn ist also möglich, wenn Phosphat entfernt wird (gekoppelte Reaktion), womit die 2. Substratkettenphosphorylierung erfolgt. Was ist nun der Warburg-Effekt (s. Ihre Vorbereitung „Kohlehydrate“)?
Fruktose entsteht beim Abbau von Saccharose und ist Teil des Invertzuckers, z.B. in Bienenhonig. Phosphorylierung erfolgt meist zu Fruktose-1-phosphat durch eine Aldolase. Entstehendes Glycerinaldehyd kann zu
- Glycerat in Mitochondrien (und damit auch Sehr) oder 2-Phosphoglycerat (nach Lamprecht, dem Begründer des Studienganges Biochemie in Hannover)
- 3-Phosphoglycerat oder
- Glycerin für Neutralfettbiosynthese
umgewandelt werden.
Bei verminderter Aktivität der Aldolase A (Leber) steigt die Verfügbarkeit von Fruktose-1-phosphat, was zur Fruktose-induzierten Hypoglykämie führt. Dieser Stoff hemmt Fruktose-1,6-bisphatase und die Aldolase. Da somit die Gluconeogenese gehemmt ist, kann die Leber keine Glucose liefern.
Fruktoseabbau spielt auch eine Rolle bei Zahnkaries. Bakteriell wird aus Glc der Saccharose ein Dextran als Zahnbelag synthetisiert, in dessen Schutz vor Speichel (Lysozym) Bakterien ungehindert wachsen und Fruktose zu Milchsäure abbauen: also beim Zähneputzen ob jetzt immer an Saccharose, Dextran und Fruktoseverwertung denken.
Fragen und Abbildungen zum Thema Kohlenhydrate
Bei Lebensmitteldeklarationen findet man die Kategorie „Kohlenhydrate, davon Zucker“.
- Entwickeln Sie Strukturformeln zur Summenformel C3H6O3, neben den Aldo- und Ketotriosen, z.B. einen Propionsäureabkömmling.
- Beschreiben Sie den Verlauf der wechselseitigen Isomerisierung von Glycerinaldehyd und Dihydroxyaceton (unter Berücksichtigung der Elektronegativität und durch sie bedingte Elektronverschiebungen).
- Warum ist Glucose (Glc) der in der Natur am häufigsten vorkommende Zucker?
- Ist Galactose (Gal) ein Enantiomer von Glc?
- Welche Produkte entstehen bei Oxidation von Glc an C1/C6?
- Warum ist die Fischerprojektion nützlich aber realitätsfern (bitte Bindungswinkel beachten)?
- Zeichnen Sie Ribose und verestern Sie die 3’,5’-OH-Gruppen mit Phosphor- oder Schwefelsäure, verbinden Sie auf diese Weise ein zentrales Säuremolekül oben und unten jeweils mit Ribose. Es entstehen Esterbindungen: welches Biopolymer entsteht?
- Was ist Saccharose?
- Was ist Invertzucker (Bienenhonig ist natürlicher Invertzucker)?
- Welche Meßdaten erklären diesen Begriff?
- Worin unterscheiden sie die Glc-Polymere Zellulose und Stärke/Glykogen strukturell?
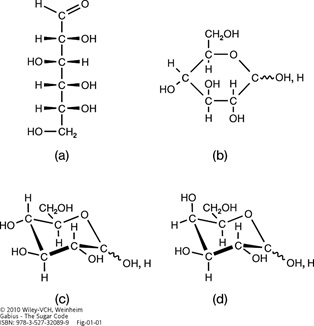
Illustration of the two types of projection formulas and the chair-like conformation of D-glucose. The open-chain (Fischer) (a) and hexopyranose (Haworth) projection formulas (b) as well as the 4C1 low-energy chair-like pyranose conformation (c) are presented. Structural variability at the anomeric center (α or β) is symbolized by a wavy line. For further information on assignment of anomeric positions and contributions of pyranose and open-chain forms to the equilibrium, please see Figure 2 and its legend. Epimer formation from D-glucose (c) to D-galactose (d) leads to the axial positioning of the 4-hydroxy group in D-galactose and changes in the topological signature of hydroxy and polarized C-H groups.
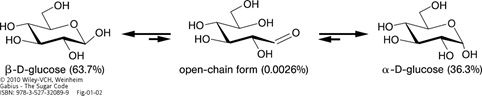
Illustration of the equilibrium including the two anomeric forms of D-glucose. The percentages of presence of the two anomeric hexopyranose and the open-chain forms in equilibrium are given in the bottom line.
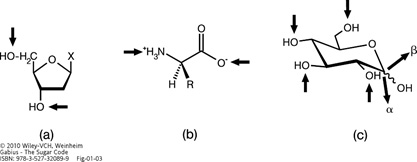
Illustration of the linkage points for oligomer formation in biomolecules by arrows. The phosphodiester bond in nucleic acid biosynthesis (a) and the peptide bond in protein biosynthesis (b) yield linear oligomers. In contrast, the glycosidic linkage in oligosaccharides can involve any hydroxy group, opening the way to linear and also branched structures (c) (for an example of branching, please see Figure 5). Using D-glucose (please see Figure 1c) as an example, its active form UDP-Glc allows conjugation of this sugar to carbohydrate acceptors to any hydroxy group, as symbolized by arrows directed towards the hydroxy groups. The anomeric position in chain elongation can vary, as symbolized by two bold arrows pointing away from the molecule (for structures of the anomers and the two 1–4-linked diglucosides with different anomeric positions, please see Figures 2 and 4).
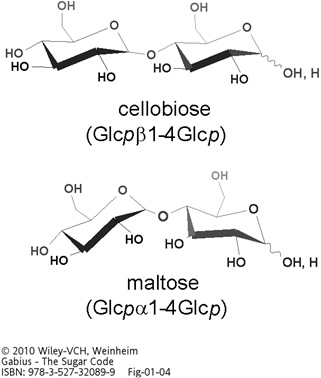
Illustration of the two 1–4-linked diglucosides cellobiose and maltose. The α- and β-anomers of D-glucose (please see Figure 2 for structures) produce diglucosides with different shapes, underscoring spatial consequences of anomer selection.
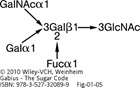
Illustration of the linkage pattern in ABH(0) histo-blood group tri- and tetrasaccharides. The core H(0)-trisaccharide (type I: α1–2-fucosylated Galpβ1–3GlcNAcp), whose L-fucose part is freely accessible to the eel lectin, can be extended in α1,3-linkage by either N-acetylgalactosamine (A epitope) or galactose (B epitope). A branched structure is generated, as intimated by arrows in Figure . For structures of the individual ‘letters’ of the ABH(0) ‘words’, please see Figure 6 .
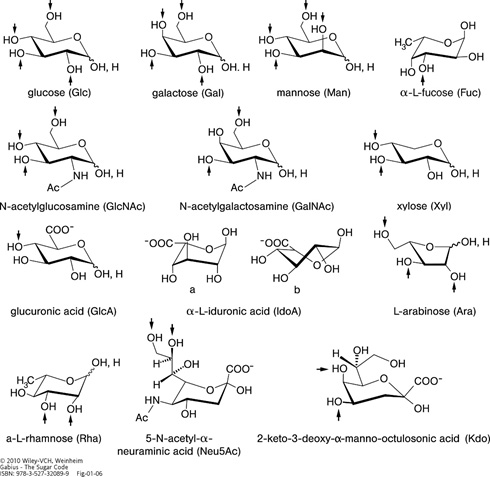
Illustration of the alphabet of the sugar language. Structural representation, name and symbol as well as the set of known acceptor positions (arrows) in glycoconjugates are given for each letter. Four sugars have L-configuration: fucose (6-deoxy-L-galactose), rhamnose (6-deoxy-L-mannose) and arabinose are introduced during chain elongation, whereas L-iduronic acid (IdoA) results from postsynthetic epimerization of GlcA at C5. The 1C4 conformation of IdoA (a) is in equilibrium with the 2SO form (b) in glycosaminoglycan chains where this uronic acid can be 2-sulfated (please see Figure 7d). All other ‘letters’ are D-sugars. Neu5Ac, one of the more than 50 sialic acids, often terminates sugar chains in animal glycoconjugates. Kdo is a constituent of lipopolysaccharides in the cell walls of Gram-negative bacteria, and is also found in cell wall polysaccharides of green algae and higher plants. Foreign to mammalian glycobiochemistry, microbial polysaccharides contain the furanose ring form of D-galactose and also D/L-arabinose indicated by an italic ‘f’ derived from the heterocyclus furan. The α-anomer is prevalent for the pentose arabinose, for example, in mycobacterial cell wall arabinogalactan and lipoarabinomannan. β1–5/6-Linked galactofuranoside is present in the arabinogalactan and the β1–3/6 linkage in lipopolysaccharides.
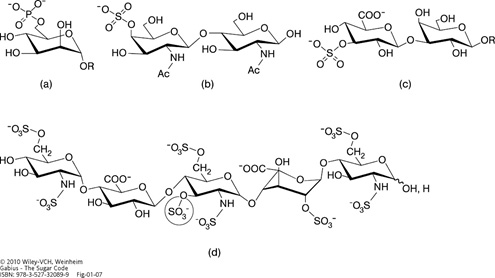
Illustration of phosphorylated (phosphated) and sulfated (sulfurylated) glycan ‘words’. 6-Phosphorylation of a mannose moiety (in the context of a mannose-rich pentasaccharide) is the key section of a routing signal in lysosomal enzymes (a), 4-sulfation of the GalNAcβ1–4GlcNAc (LacdiNAc) epitope forms the ‘postal code’ for clearance from circulation by hepatic endothelial cells of pituitary glycoprotein hormones labeled in such a manner (b), the HNK (human natural killer)-1 epitope (3-sulfated GlcAβ1–3Galβ1–4GlcNAc) is involved in cell adhesion/migration in the nervous system (c) and the encircled 3-O-sulfation in the pentasaccharide's center is essential for heparin's anticoagulant activity (d). All sugars are in their pyranose form. Please note that the central GlcN unit has N,O-trisulfation and that the 2-sulfated IdoA, given in the 1C4 conformation, can also adopt the hinge-like 2SO skew-boat structure (please see Figure 6; about 60% or more for the 2SO form in equilibrium depending on the structural context) when present within glycosaminoglycan chains of the proteoglycan heparin. 2-Sulfation of IdoA serves two purposes: favoring the hinge-like 2SO conformation and precluding reconversion to GlcA.
Haben Sie Fragen?
Wenn ja, gehen Sie hierfür auf die sli.do Internetseite: https://app.sli.do/event/u8b3pzuq
Der Code für Biochemie Fragen im SS 2021 lautet: # 955466

